Science Advances| 程柯团队研发新冠、流感双杀疫苗
自2019年疫情爆发以来,新冠病毒造成的COVID-19大流行已经导致全球超过7.6亿人次感染和694万病例死亡,对公共卫生、社会和经济基础设施造成了严重的破坏。除了新冠病毒,季节性流感病毒每年导致近65万病例死亡。且新冠病毒和流感病毒具有相似的临床表现、共同的传播机制、相同的感染部位,且季节性吻合。据临床报道显示,感染流感病毒会增强新冠病毒对宿主细胞的侵袭能力,从而导致新冠感染率升高、肺部损伤加重以及死亡率上升的情况。但目前已上市的新冠疫苗和流感疫苗分别只针对新冠病毒和流感病毒提供保护,难以兼顾两者。因此,开发一种能够同时预防这两种流行病的疫苗至关重要。
2023年6月23日,美国北卡罗来纳州立大学程柯教授团队在Science 子刊Science Advances发表了题为:A SARS-CoV-2 and influenza double hit vaccine based on RBD-conjugated influenza A virus的研究论文。该论文将新冠病毒 刺突蛋白的受体结合结构域(RBD)与灭活的甲型流感病毒H1N1(Flu)相结合,研发了一个新型双效疫苗,可同时针对流感病毒和新冠病毒。

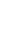
新冠病毒是通过刺突蛋白的RBD与宿主细胞表面血管紧张素转换酶2 (ACE2)受体相结合从而进入宿主细胞,这使得RBD成为中和抗体以及亚单位疫苗的特异性靶标。而自甲型H1N1流感病毒在人类中传播以来,接种减活流感疫苗和灭活流感疫苗是预防流感大流行最行之有效的策略。其中,灭活流感疫苗表现出良好的安全性和内在免疫原性。受此启发,程柯教授团队通过click反应,将RBD结合到灭活甲型H1N1流感病毒表面(Flu-RBD),创造了针对新冠、流感、及新冠流感共感染的新冠病毒样颗粒疫苗(VLP)。该疫苗具有双重保护效果,不仅能诱导产生RBD特异性lgG抗体,还能激发血凝素(HA)抗原产生特异性抗体反应(图1)。
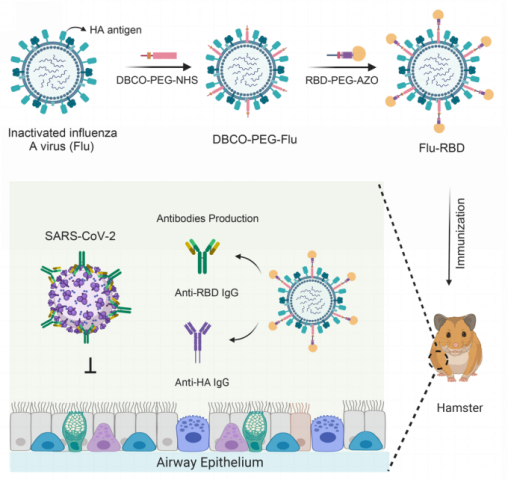
图1:Flu-RBD VLP疫苗在仓鼠体内诱导产生RBD特异性抗体以及HA抗原特异性抗体。
成功制备Flu-RBD VLP疫苗后,该团队研究了该疫苗诱导的免疫反应。研究结果显示两剂Flu-RBD VLP疫苗在小鼠体内诱导了强烈的体液免疫应答:相比于RBD与Flu简单混合组(Flu-M-RBD),接种Flu-RBD的小鼠血清中检测到了更高含量的RBD特异性IgG抗体(图2B),同时Flu-RBD疫苗诱导了最为平衡的TH1免疫反应(图2B和2C)。此外,该团队发现Flu-RBD VLP疫苗可激活CD4+辅助性T细胞和CD8+细胞毒性T细胞,并诱导TH1偏向的免疫应答(图2E和2F)。在验证了Flu-RBD VLP疫苗具有新冠疫苗的应用潜力后,程柯团队还证明了该疫苗保留了其作为流感疫苗的免疫原性:其诱导产生的HA抗体滴度(图2G)与流感病毒疫苗相当,且主要是以lgG2a亚型为主(图2H),同时可诱导产生IFN-γ+ CD4+ T细胞和IFN-γ+ CD8+ T细胞,表明其诱导的HA反应也是TH1偏向的免疫应答(图2I和2J)。
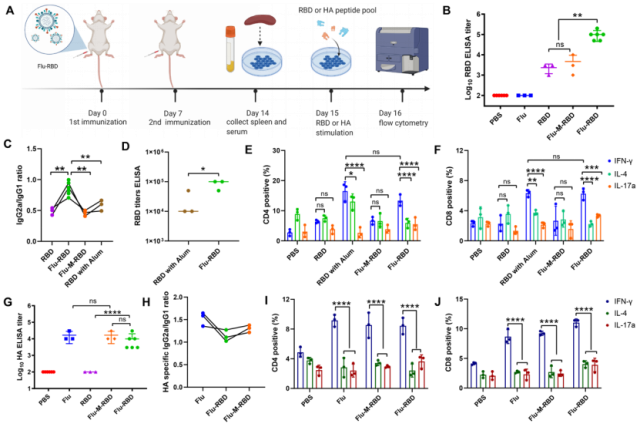
图2:Flu-RBD VLP疫苗诱导小鼠产生体液免疫反应。(A)接种疫苗实验设计。(B)小鼠血清中RBD抗体滴度。(C)RBD特异性的lgG2a与lgG1亚型抗体的比率。(D)比较Flu-RBD与RBD佐剂组诱导产生的抗体滴度含量。RBD肽段刺激后,脾细胞中CD4+ T细胞(E)和CD8+ T细胞(F)的IFN-γ+、IL-4+及IL-17+细胞百分比。小鼠血清中HA抗体滴度(G)和HA特异性lgG2a与lgG1亚型抗体的比率(H)。HA肽段刺激后,脾细胞中CD4+ T细胞(I)和CD8+ T细胞(J)的IFN-γ+、IL-4+及IL-17+的细胞百分比。
在成功验证Flu-RBD VLP疫苗可诱导多重免疫反应后,该团队应用COVID-19仓鼠模型评估Flu-RBD VLP疫苗预防新冠病毒的能力(图3)。在接种两剂Flu-RBD VLP疫苗后,成功降低了仓鼠的支气管肺泡灌洗液(BAL)以及口腔拭子(OS)中的新冠病毒病毒载量(图3B和3C),并且能同时诱导产生RBD特异性的IgG抗体和HA特异性的IgG抗体(图3D-F)。仓鼠肺组织病理学研究(H&E、Trichrome染色、组织病理学评分和Ashcroft评分)表明,相比于PBS、Flu和Flu-M-RBD组,接种Flu-RBD VLP的仓鼠肺炎症状明显减轻,保留了肺泡组织上皮结构的完整性,同时降低了肺纤维化的发生(图3G-J)。这些结果表明,Flu-RBD VLP疫苗能够有效地保护仓鼠免受新冠病毒感染。
图3:Flu-RBD VLP疫苗保护仓鼠免受新冠病毒感染。(A)仓鼠实验设计示意图。(B)仓鼠BAL中的病毒载量。(C)仓鼠OS中的病毒载量。(D)仓鼠感染前和感染后RBD特异性lgG抗体滴度。感染后不同时间内,仓鼠血清中RBD (E)和HA (F)特异性的lgG抗体滴度。(G)仓鼠肺组织H&E染色。(H)仓鼠肺组织病理学雷达图。(I)仓鼠肺组织Masson图。(J)Ashcroft评分评估仓鼠肺纤维化。
新冠病毒变异株的持续出现对新冠疫苗的预防效果构成了严重威胁,尤其是Delta变异株(B.617.2),导致许多国家的新冠感染率急剧上升。然而,该团队发现接种两剂Flu-RBD VLP疫苗,可有效加快小鼠清除吸入的Delta变异株假病毒(图4A-C)。激光共聚焦成像结果表示,相比于Flu,RBD和Flu-M-RBD组,接种Flu-RBD的小鼠肺支气管及肺实质中的Delta假病毒信号表现出明显的下降(图4D-F)。此外,接种Flu-RBD小鼠的血清可有效阻止Delta假病毒进入表达ACE2的A549细胞内(图4G和4H),表明其具有强大的交叉保护能力。
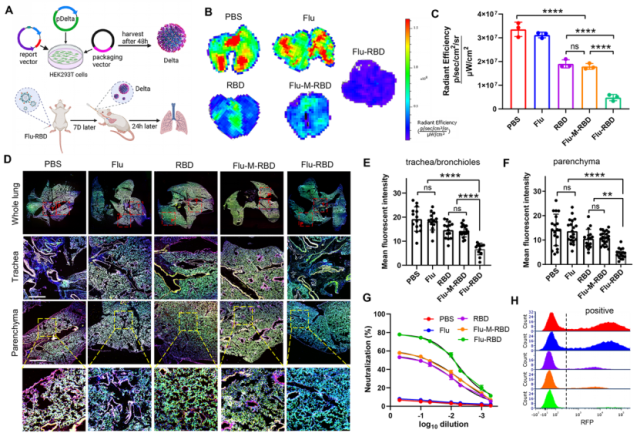
图4:Flu-RBD VLP疫苗中和新冠病毒 Delta假病毒。(A)制备SAR-CoV-2 Delta假病毒示意图。小鼠肺组织Delta假病毒的ex-vivo成像图(B)以及其定量分析(C)。(D)小鼠肺组织的激光共聚焦成像图。小鼠肺支气管、细小支气管(E)及肺实质(F)的Delta假病毒定量分析。(G)接种疫苗后的小鼠血清中和Delta假病毒曲线图。(H)接种疫苗后的小鼠血清抑制Delta假病毒进入宿主细胞的流式图。
综上所述,Flu-RBD VLP疫苗是针对新冠病毒、流感病毒及新冠、流感共感染的候选疫苗。不同于Novavax和Pfizer公司将新冠疫苗与流感疫苗进行简单联合接种,Flu-RBD VLP疫苗是一种能同时靶向两种呼吸道病毒的单一疫苗,这种一箭双雕的疫苗更具成本效益,增强了免疫原性,提高了患者的便利性,能缓解公众对疫苗接种的疲劳。该疫苗将为开发针对循环病毒共感染的疫苗提供新的见解,值得进一步的研究与开发。
程柯教授是本文的通讯作者。王真真博士(现全职加入华南理工大学生物医学科学与工程学院)为本文的第一作者。
(来源:生命科学前沿)
原文出处:Wang Z, Li Z, Shi W, Zhu D, Hu S, Dinh PC, Cheng K. A SARS-CoV-2 and influenza double hit vaccine based on RBD-conjugated inactivated influenza A virus. Sci Adv. 2023 Jun 23;9(25):eabo4100. doi: 10.1126/sciadv.abo4100. Epub 2023 Jun 23. PMID: 37352360; PMCID: PMC10289656.